細胞技術
-
-
幹細胞技術

-
2020年1月2日,上海市民營企業科技創新基地座談會暨授牌儀式順利舉行,復星醫藥作為民營科創企業代表,幹細胞治療藥物重點實驗室成功入選,獲授上海市幹細胞治療藥物重點實驗室!這是上海市重點實驗室首次花落民企。上海市委常委、副市長吳清出席座談會,並為民營企業科技創新基地授牌。
復星醫藥針對有巨大需求的腦卒中患者和致盲性視網膜罕見疾病患者,和英國ReNeuron公司合作,共同研發異體幹細胞治療產品,分別用於治療腦卒中後殘疾和視網膜色素變性導致的失明,兩種適應症目前在全球範圍內均無有效治療手段。為推進產業化,復星醫藥積極成立了「幹細胞治療藥物重點實驗室」,全力推進全球臨床研究,啟動技術轉移,使幹細胞治療儘早惠及中國及全球的患者。復星醫藥將以這兩款幹細胞技術為抓手,力爭在近年內打造完善的幹細胞技術平台。實驗室將通過引進國外先進技術和人才,整合一支以幹細胞技術核心骨幹為主,技術環節優秀人才儲備完善的團隊,打造幹細胞行業獨角獸,力爭達到國際領先水準!
-
-
-
-
細胞治療平台

-
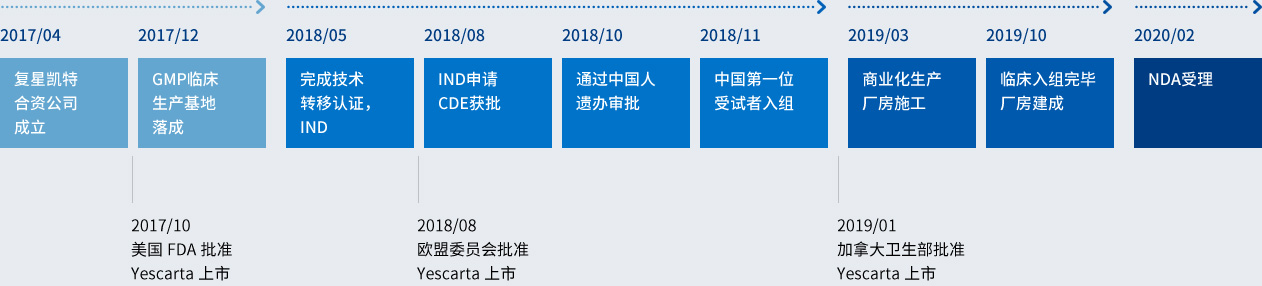
復星凱特生物科技有限公司為復星醫藥集團與美國Kite Pharma(吉利德旗下公司)的合營企業,2017年4月於中國上海註冊成立。立足於自主研發和技術轉移相結合,復星凱特致力於腫瘤免疫細胞治療技術的產業化和規範化,造福中國患者。
作為中國領先的醫療健康產業集團,復星醫藥具有豐富的藥品製造與研發經驗,並在腫瘤治療領域擁有多項在研產品。Kite Pharma在T細胞免疫治療領域的研發處於全球領先地位。合營企業的成立將利用雙方資源優勢,共同打造中國領先的T細胞免疫治療產業平台,共同為中國腫瘤患者提供安全、有效的T細胞免疫治療產品。
-

研發
核心自主研發平台
戰略合作開發夥伴
商業化細胞治療產品開發能力 -

生產
應細胞治療產品特點的一體化供應鏈;
迅速的細胞治療產品技術轉移能力;
符合GMP標準的本土化生產能力、嚴格的細胞治療產品品質控制 -
臨床
臨床前資料的迅速產生能力;
豐富的細胞治療產品臨床試驗經驗;
細胞治療產品註冊的經驗與轉化醫學能力。 -

商業化
符合中國市場的商業模式
學術推廣能力
銷售網路
-
-
基因技術
COVID-19 mRNA疫苗項目介紹
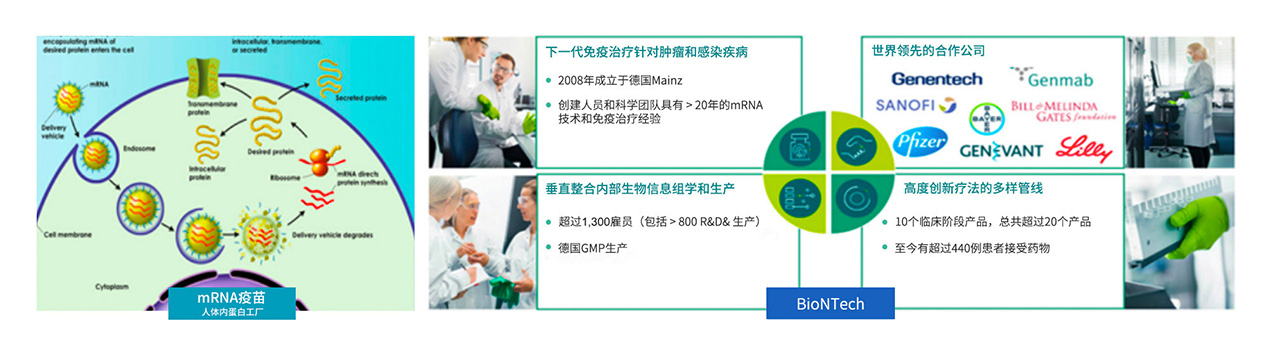
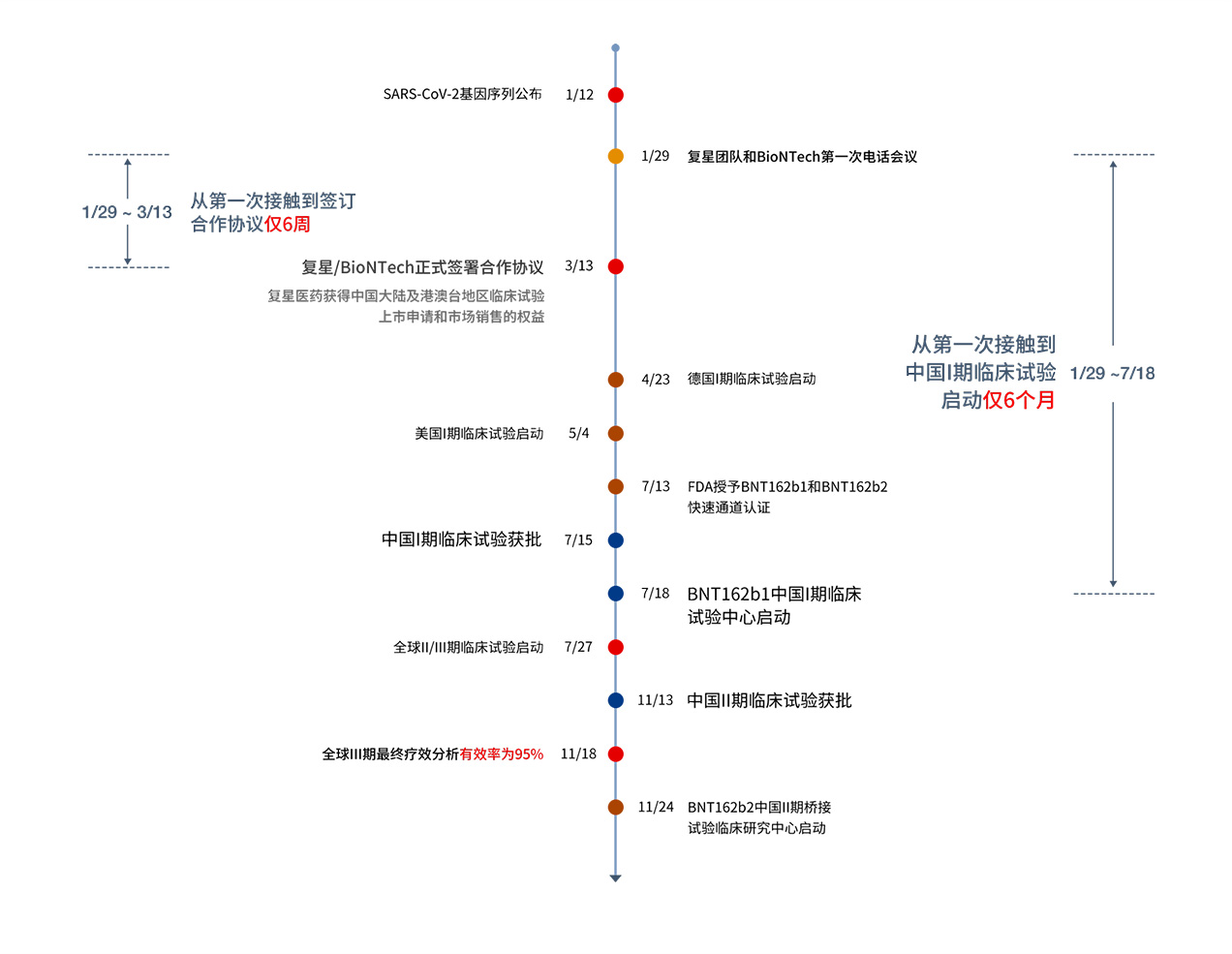
2020年初,COVID-19在全球各地爆發。復星醫藥積極調研全球疫苗研發進展,尋求國際合作,最終選定mRNA疫苗領域技術領先的德國BioNTech公司作為合作夥伴。2020年3月16日,復星醫藥宣佈與德國BioNTech簽署合作協議,獲得BioNTech通過RNA技術平台研發的針對新型冠狀病毒的疫苗(包括BNT162候選疫苗等)在中國大陸及港澳台地區的臨床開發及商業化權益。
復星與BioNTech聯合研發抗新冠病毒mRNA疫苗1COVID-19 mRNA疫苗項目
-
- 成功合作11 COVID-19 mRNA疫苗項目
- 復星對疫情的大局觀及強烈的社會責任感
- mRNA疫苗的優勢
- BioNTech的領先技術復星醫藥的研發能力及快速反應力
-
- mRNA疫苗11 COVID-19 mRNA疫苗項目
- 研發週期短
- 雙重作用機制:體液免疫/細胞免疫
- 強效,不需佐劑安全
- 工藝簡單,快速批量生產
-
- BioNTech領先技術111COVID-19 mRNA疫苗項目
- 多樣化mRNA技術綜合研發能力
- 強效安全脂質納米顆粒傳遞
- 大於250例人體mRNA試驗經驗
- 初步臨床腫瘤疫苗療效高產能
- 廣闊免疫治療平台
復星引進的BioNTech公司的mRNA疫苗包含三種不同形式,分別是尿苷mRNA、核甘修飾mRNA以及自擴增mRNA。這三種疫苗形式,有各自不同的優勢,如下表所示。
-
-
尿苷 mRNA 11包含三種不同形式 (uRNA/BNT162 a1)111包含三種不同形式
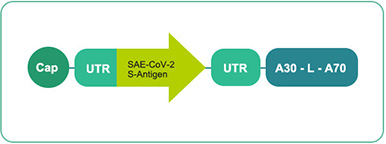
臨床階段技術生產
和CMC工藝到位 -
依據 :
內源佐劑效應
預期非常好的耐受性和安全性
抗體&強的T細胞反應
-
-
-
核苷修飾 mRNA (modRNA/BNT162 b1&b2)
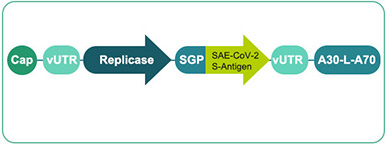
臨床階段技術
生產和CMC工藝到位 -
依據 :
較少的佐劑效應
預期非常好的耐受性和安全性
強的抗體反應&CD4 T細胞反應
-
-
-
自擴增mRNA (modRNA/BNT162 b1&b2)
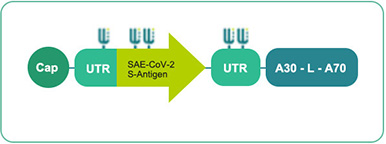
臨床階段技術
已有GLOP毒理數據
生產和CMC工藝到位 -
依據 :
長期蛋白表達
預期非常好的耐受性和安全性
高度可能的單次給藥後出現良好的免疫反應
較高可能出現極低疫苗劑量的有效性
-
為了抵禦疫情,復星醫藥和BioNTech在全球範圍攜手進行mRNA疫苗研發:
2020年4月,復星醫藥和中國醫學科學院動研所啟動了小鼠攻毒試驗,並及時與合作方分享了試驗結果。
2020年4月和5月,BioNTech啟動BNT162b1/b2的I/IIa期臨床試驗。
2020年7月18日,在合作方資料分享基礎上,復星醫藥啟動BNT162b1中國I期臨床試驗。
- 2020年7月27日,經過多方評估最終選定BNT162b2進入全球IIb/III期臨床試驗。
11月9日,第一次中期分析結果顯示BNT162b2在完成接種程式後7天的有效性超過90%。
11月13日,復星醫藥獲批在國內開展BNT162b2的II期橋接試驗。
11月18日,全球III期臨床試驗的最終療效分析顯示, BNT162b2達到了研究的所有主要療效終點,有效率達95%。
11月24日,復星醫藥在江蘇泰州舉行了II期臨床試驗啟動會
復星醫藥正全力以赴,爭取儘早完成這一疫苗的臨床開發、註冊和上市。
BioNTech/復星合作開發mRNA疫苗時間軸
腫瘤疫苗SurVaxM 介紹
SurVaxM是基於創新合成多肽的治療性疫苗,靶向Survivin凋亡抑制蛋白,該蛋白存在於90%的惡性膠質瘤和許多其他癌症細胞內部或表面。SurvAxM具有刺激T細胞免疫,以及抗體介導的Survivin通路抑制的雙重作用機制,可以控制腫瘤生長,預防或延緩腫瘤復發。
該項目於2019年11月從美國MimiVax, LLC獲得獨家許可引進, 在中國大陸、香港及澳門進行膠質母細胞瘤以及其他腫瘤適應症的臨床開發,註冊上市及銷售。
-
-
萬新科技

-
溶瘤病毒療法是一種通過病毒選擇性感染腫瘤細胞來殺傷腫瘤的新型腫瘤治療方法。溶瘤病毒是一類具有複製能力的腫瘤殺傷型病毒,能選擇性感染腫瘤細胞並在腫瘤細胞中複製繼而殺傷腫瘤細胞,並刺激機體產生特異性抗腫瘤免疫反應。自然界中只有少數病毒可以自然地發生溶瘤,大多數需要進行基因改造後才能實現對腫瘤細胞的靶向感染和治療的作用。作為腫瘤免疫的重要組成部分,與其他腫瘤免疫療法相比具有如下優勢:
1)作用於腫瘤免疫的多個環節,廣譜抗癌,對復發和轉移的腫瘤依然有效;
2)安全性可靠,副作用較小,未觀察到劑量限制性毒性反應。目前全球多個藥物進入臨床Ⅲ期,且在臨床試驗中展示出了良好甚至是顛覆性的治療效果,尤其是在一些生存率極低的癌症如膠質瘤爆發出巨大的潛力,部分患者甚至實現了持久的病情緩解,讓我們看到了治療癌症的曙光。目前復星醫藥已啟動溶瘤病毒產品的開發,處於臨床前研究階段。
-