-
-

- 2023-09-06
零突破!复星桂林南药首个口服制剂获美国FDA批准上市
8月31号,复星医药成员企业桂林南药股份有限公司承接生产的广谱抗菌药磺胺甲噁唑甲氧苄啶片800mg/160mg规格获美国FDA批准上市,实现了口服制剂生产线品种获得FDA批准上市的零突破。对桂林南药扩展海外市场和国际化能力提升具有重大意义。
-
-
-

- 2023-07-25
复星医药自研MEK1/2抑制剂FCN-159片获第二项突破性疗法认定
(2023年7月25日,中国上海)7月25日,植根中国、创新驱动的全球化医药健康产业集团上海复星医药(集团)股份有限公司(“复星医药”,股票代码:600196.SH;02196.HK)宣布,控股子公司上海复星医药产业发展有限公司(“复星医药产业”) 自主研发的MEK1/2抑制剂FCN-159片(“该新药”)用于治疗无法手术或术后残留/复发的 NF1(即I型神经纤维瘤)相关的丛状神经纤维瘤成人患者已被国家药品监督管理局(NMPA)药品评审中心(CDE)纳入突破性治疗品种。这是继今年4月,FCN-159片针对组织细胞肿瘤的适应症之后,第二个适应症被纳入突破性疗法认定。
-
-
-

- 2023-07-12
复星医药创新药盐酸替纳帕诺片获上市申请受理 用于治疗慢性肾脏病血透患者高磷血症
(2023年7月12日,中国上海)7月12日,上海复星医药(集团)股份有限公司(“复星医药”,股票代码:600196.SH;02196.HK)宣布,控股子公司上海复星医药产业发展有限公司(“复星医药产业”)获许可创新药Tenapanor片(盐酸替纳帕诺片,“该新药”)用于控制正在接受血液透析治疗的慢性肾脏病(CKD)成人患者的高磷血症的药品注册申请于近日获国家药品监督管理局(“国家药监局”)审评受理。Tenapanor片是复星医药从Ardelyx许可
-
-
-

- 2023-07-06
复星医药创新型肉毒素产品RT002治疗适应症上市申请获受理
(2023年7月6日,中国上海)7月6日,创新驱动的全球化医药健康产业集团上海复星医药(集团)股份有限公司(“复星医药”,股票代码:600196.SH、02196.HK)宣布,控股子公司上海复星医药产业发展有限公司(“复星医药产业”)许可引进的RT002(即DaxibotulinumtoxinA型肉毒杆菌毒素)用于治疗成人颈部肌张力障碍的药品注册申请于近日获国家药品监督管理局(“国家药监局”)审评受理。
-
-
-
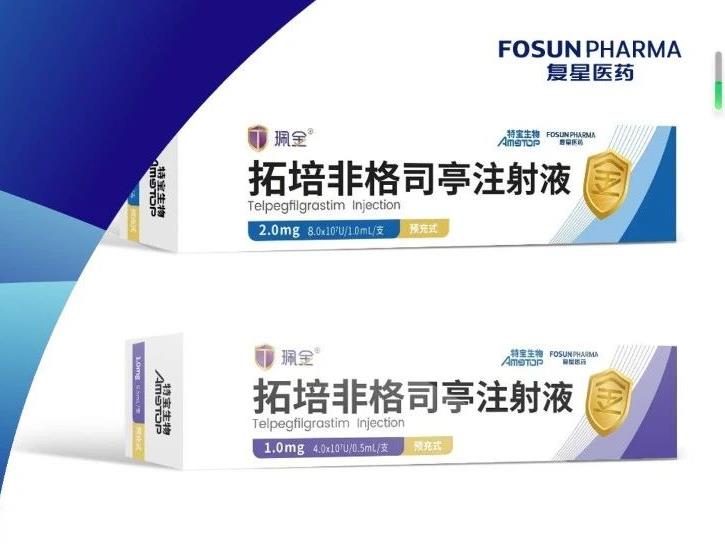
- 2023-07-01
新一代长效升白药,珮金®(拓培非格司亭)正式获批上市!
6月30日,国家药品监督管理局正式批准特宝生物研发的Ⅰ类新药、新一代长效重组人粒细胞集落刺激因子“拓培非格司亭注射液”(商品名“珮金®”)上市。此前,复星医药控股子公司江苏复星医药销售有限公司已与特宝生物签署《关于拓培非格司亭注射液(珮金®)的独家商业化协议》,江苏复星已获得拓培非格司亭注射液在中国大陆地区(香港特别行政区、澳门特别行政区和台湾地区除外)的独家推广及销售权利。
-
-
-

- 2023-06-26
中国首款!复星凯特CAR-T产品奕凯达®新增获批二线适应症
2023年6月26日,中国上海)6月26日,创新驱动的全球化医药健康产业集团上海复星医药(集团)股份有限公司(“复星医药”,股票代码:600196.SH、02196.HK)宣布,合营公司复星凯特生物科技有限公司(“复星凯特”)的阿基仑赛注射液(商品名:奕凯达®;以下简称“该产品”)用于治疗一线免疫化疗无效或在一线免疫化疗后12个月内复发的成人大B细胞淋巴瘤(r/r LBCL)(“本次新增适应症”)的上市注册申请于近日获国家药品监督管理局 (“国家药监局”)附条件批准。这也标志着奕凯达®二线适应症正式上市。
-
-
-
- 2023-05-17
复宏汉霖创新型抗HER2单抗HLX22 I期研究成果发表于Investigational New Drugs
近日,复宏汉霖HLX22(创新型抗HER2单抗)针对HER2过表达的晚期实体瘤的I期临床研究数据发表于期刊Investigational New Drugs。研究结果显示,HLX22在HER2过表达的晚期实体瘤患者中具有良好的安全性和耐受性,为HLX22与曲妥珠单抗等产品联合疗法的开展奠定了基础。
-
-
-

- 2023-05-10
新型拟钙剂依特卡肽获批上市,中国CKD伴SHPT患者迎来新希望
5月6日,复星医药宣布其与安进合作获独家商业化授权的新型注射剂型拟钙剂依特卡肽(商品名:旁必福®)获国家药品监督管理局(NMPA)批准上市。用于治疗慢性肾脏病(CKD)接受血液透析的成人患者的继发性甲状旁腺功能亢进症(SHPT)。
-
-
-

- 2023-04-21
复星医药抗肿瘤新药FCN-159片获CDE突破性疗法认定
(2023年4月21日,中国上海)4月21日,植根中国、创新驱动的全球化医药健康产业集团上海复星医药(集团)股份有限公司(“复星医药”,股票代码:600196.SH;02196.HK)宣布,控股子公司上海复星医药产业发展有限公司(“复星医药产业”)在研新药FCN-159片(“该新药”)被国家药品监督管理局(NMPA)药品评审中心(CDE)认定为突破性治疗品种,拟用于治疗组织细胞肿瘤。CDE将对纳入突破性治疗药物程序的药物优先配置资源进行沟通交流,加强指导并促进药物研发,有望进一步缩短药物临床研发周期。
-






